2020.08.17.
多能性幹細胞のプライム型からナイーブ型への変換機構の解明−ヒトナイーブ型多能性幹細胞の樹立法開発へ向けて−
関由行・理工学部准教授らのグループ
関西学院大学/熊本大学発生医学研究所
関西学院大学理工学部の山本真容子氏(元大学院生)と関由行(せき・よしゆき)准教授、および熊本大学発生医学研究所の中村輝教授らは、転写因子PRDM14が標的遺伝子を識別し、適切な複合体を割り振ることで、「プライム型」から「ナイーブ型」へ多能性幹細胞[1]を変換することを発見しました。本研究成果は、発生過程における多能性細胞の維持や始原生殖細胞[2]における初期化機構の一端を明らかにするものです。今後、ES細胞から卵・精子への誘導法開発や、ヒト多能性幹細胞のナイーブ化に繋がる可能性があり、生殖補助医療や再生医療の発展に貢献することが期待できます。
今回、共同研究チームは質量分析を用いて転写因子PRDM14の複合体成分を網羅的に同定し、標的遺伝子の状態に依存してPRDM14が複合体成分を切り替えていることを突き止めました。さらに、CRISPR/Cas9システム[3]を用いた遺伝子破壊実験により、PRDM14を起点とした複合体形成の階層性を明らかにしました。これまで、エピジェネティック[4]因子であるポリコム複合体のPRDM14による転写制御に対する相反する結果が報告されていました。本研究では、仲介因子CtBP1/2がPRDM14とポリコム複合体の橋渡しをしていること突き止め、長年の議論に決着をつけたことになります。
この研究成果は、8月14日、英国科学雑誌「Journal of Cell Science」に公表されました。
《研究支援》
本研究は、科学研究費補助金若手研究(A)、基盤研究(B) 、新学術領域研究「生殖細胞のエピゲノムダイナミクスとその制御」、「動物における配偶子産出システムの制御」、「全能性プログラム:デコーディングからデザインへ」及び熊本大学発生医学研究所共同研究拠点の支援を受けて行われました。
ポイント
・質量分析(LC-MS/MS)によって転写因子PRDM14の複合体成分を同定
・転写調節因子CtBP1/2がPRDM14とポリコム複合体の結合を仲介
・CtBP1/2は多能性幹細胞の基底状態の維持に必須
《研究の背景》
多能性幹細胞と生殖細胞に多くの共通点があり、その共通点を生み出しているタンパク質の一つが転写因子PRDM14です。研究グループは、転写因子PRDM14が、分化を促進する遺伝子の発現を抑制(オフ)し、分化を抑える遺伝子の発現を活性化(オン)することで、多能性を維持するために必要な遺伝子ネットワークを確立することを突き止めていました。しかしながら、PRDM14が標的遺伝子の種類や状態によって、どのように遺伝子のオン・オフを切り替えているのか、その分子機構は不明なままでした。そこで、今回共同研究グループは、質量分析を利用してPRDM14に結合するタンパク質群を網羅的に同定し、標的遺伝子依存的な複合体成分の切り替え機構の解明を目指しました。。
《研究手法と成果》
質量分析を用いて転写因子PRDM14に結合するタンパク質群を網羅的に同定したところ、転写活性に関与するクロマチンリモデリング複合体と転写抑制活性を持つNODE複合体が含まれることを突き止めました。この複合体成分の中で共同研究グループは、エピジェネティック修飾を介して転写抑制を行うポリコム複合体と転写因子の結合を仲介するCtBP1/2に着目し、機能解析を進めました。
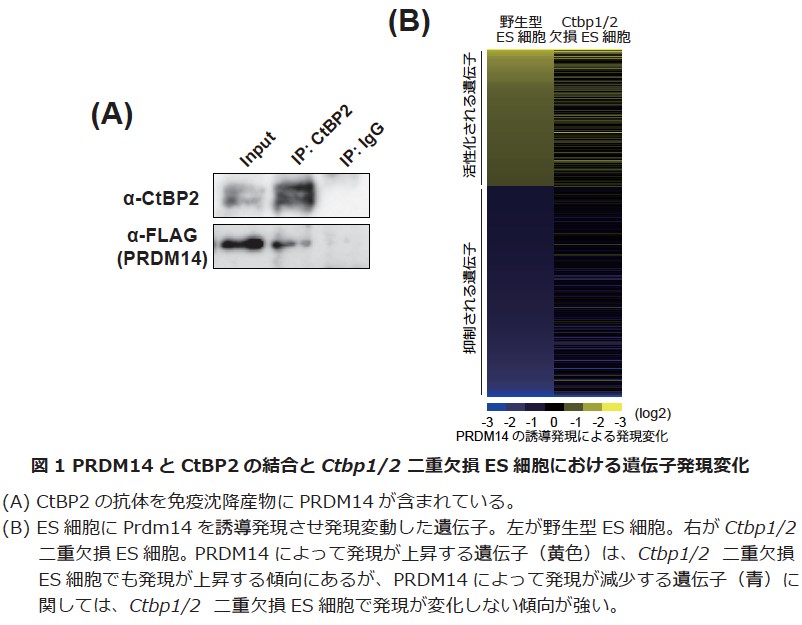
まず、PRDM14複合体におけるCtBP1/2の機能解析を行うために、CRISPR/Cas9システムを用いてCtbp1/2遺伝子破壊ES細胞を樹立しました。このES細胞にPRDM14を誘導発現させたところ、PRDM14の誘導発現による遺伝子発現抑制の一部が破綻することを突き止めました(図1)。また、CtBP1/2非存在下では、PRDM14はポリコム複合体を標的遺伝子領域へリクルートできず、PRDM14-CtBP1/2―ポリコム複合体の順番で標的遺伝子上に複合体を作り、遺伝子発現を抑制していることも明らかにしました。
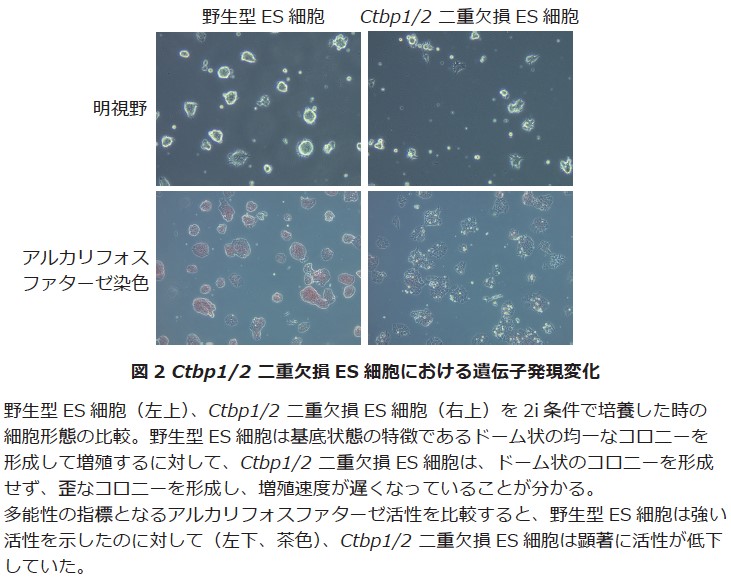
ES細胞は2種類のリン酸化酵素阻害剤(2i)を添加することで、ES細胞の状態を発生初期の多能性細胞(基底状態:Ground state)へ近づけることができます。この際、Prdm14の発現が上昇することから、Ctbp1/2遺伝子破壊ES細胞を2i条件で培養したところ、予想と反して細胞の形態異常及び増殖能の低下が観察されました(図2)。このような表現系はPrdm14遺伝子破壊ES細胞では観察されません。したがって、CtBP1/2はPRDM14とは独立した機構でES細胞の基底状態を維持していることが分かります。
《今後の期待》
本研究から、転写因子PRDM14は標的遺伝子の状態を識別し、異なる機能を発揮することで、「プライム型」から「ナイーブ型」へ多能性幹細胞を変換していることが分かりました。また、当初の予測とは異なり、転写調節因子CtBP1/2が基底状態ES細胞の維持に重要であることも突き止めました。 基底状態ES細胞では、未分化性を維持する遺伝子ネットワークが強固に構築されており、基底状態ES細胞特異的な異常は過去に報告がありません。基底状態ES細胞は細胞の性質が均一であることから、再生医療に供給する細胞のリソースとして注目を集めています。今後、CtBP1/2によるES細胞の基底状態維持機構を解明することで、マウスだけではなくヒト多能性幹細胞を基底状態に誘導・維持する方法の開発に繋がることが期待できます。
《論文タイトル》
PRDM14-CtBP1/2-PRC2 complex regulates transcriptional repression during transition from primed to naïve pluripotency
(和訳:PRDM14-CtBP1/2-PRC2複合体は多能性幹細胞の「プライム型」から「ナイーブ型」への変換を制御する)
《著者》
Maiko Yamamoto, Yoshiaki Suwa, Kohta Sugiyama, Naoki Okashita, Masanori Kawaguchi, Naoki Tani, Kazumi Matsubara, Akira Nakamura, and Yoshiyuki Seki
《論文URL》
https://jcs.biologists.org/content/133/15/jcs240176
《ご参考》
筆頭著者の山本真容子氏(元大学院生)インタビュー記事:
https://jcs.biologists.org/content/133/15/jcs251900
《問い合わせ先》
■関西学院広報室
TEL 0798-54-6017 ※8月23日までは夏季休暇閉室
■関西学院大学 理工学部 生命医化学科
関 由行
E-mail
yseki@kwansei.ac.jp
多能性幹細胞のプライム型からナイーブ型への変換機構の解明PDFリンク

